LIF(白血病抑制因子)的前世今生
LIF(白血病抑制因子)的前世今生
LIF的英文全稱為Leukemia Inhibitory Factor,中文譯為白血病抑制因子,其為一種具有多種功能的細胞因子,但其最重要的應用是維持小鼠胚胎干細胞的未分化狀態。為幫助您更好的選擇和使用LIF,特與大家分享此文。 |
LIF從發現、克隆到2013年已經有25年的歷史了。那么LIF是如何被發現的呢?這要從白血病的治療說起。
我們知道,正常的血液細胞是終末分化的細胞。存在于骨髓或外周血等處的微量造血干/祖細胞經過增殖和分化后可成為成熟的血液細胞,以不斷補充死去的成熟血液細胞。如果造血干/祖細胞的增殖、分化過程受到異常調節,這些細胞將停留在幼稚的細胞階段,而數目仍在不斷增加,這就是白血病的成因。因此,白血病是造血細胞的增殖和分化過程失去正常的控制而形成的。科學家一直在尋找能夠促進白血病細胞分化,同時又能抑制其增殖的細胞因子或藥物,以期治療白血病[1]。
19世紀80年代已發現了一些調節造血細胞增殖和分化的細胞因子,如G-CSF(粒細胞集落刺激因子)、M-CSF(巨噬細胞集落刺激因子)、GM-CSF(粒細胞巨噬細胞集落刺激因子),Multi-CSF(即現在的IL-3)和IFN-γ(干擾素-γ)等。這些細胞因子的共同特點是:既能促進造血細胞的分化,又能刺激它們的增殖。這就帶來一個問題,即這些細胞因子在促進白血病細胞分化的同時,也會大量增加白血病細胞的數量,這樣可能會加重白血病的病情,而不是治療白血病。所以,科學家試圖仍然需要找到一種只誘導白血病細胞分化,但不促進白血病細胞增殖的細胞因子來治療白血病。
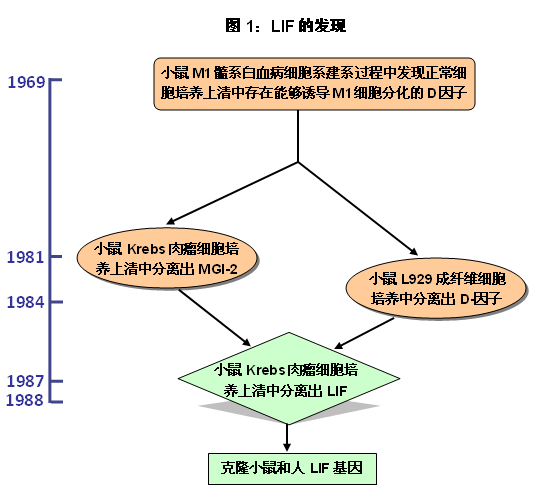
1969年在從SL品系小鼠的自發髓系白血病體外建系(即后來我們所熟知的小鼠M1髓系白血病細胞系,常用于重組LIF蛋白的生物活性檢測)的過程中,研究人員發現,正常細胞的培養液可誘導M1白血病細胞系分化為成熟的巨噬細胞或粒細胞。研究人員將培養液中的這些未知的誘導成分統稱為Differentiation Stimulating Factor,即分化刺激因子,簡稱D-factors (D-因子)[2]。
1981年[3]年和1984年[4]科學家分別從小鼠Krebs肉瘤細胞和小鼠 L929成纖維細胞的培養液中鑒定出MGI-2(Macrophage and Granulocyte Inducing-2,巨噬細胞和粒細胞誘導-2)和一種D-因子,兩者均可誘導小鼠M1髓系白血病細胞的分化,而不刺激正常造血細胞的增殖。
緊接著在1987年,澳大利亞皇家墨爾本醫院沃爾特與伊麗莎醫學研究所(Walter and Eliza Hall Institute (WEHI), Royal Melbourne Hospital)的Donald Metcalf實驗室從小鼠Krebs肉瘤細胞培養液中分離出可以誘導小鼠M1髓系白血病細胞分化的蛋白,因該蛋白具有抑制M1髓系白血病細胞增殖的作用,因而被命名為白血病抑制因子,即Leukemia Inhibitory Factor (LIF)。同時發現,該蛋白不能刺激正常髓系前體細胞的增殖。 Donald Metcalf等認為LIF與前面所發現的MGI-2和D-因子是同一種物質,因他們最大的共同點是均可誘導小鼠M1髓系白血病細胞向巨噬細胞分化。至此,LIF蛋白被正式發現和命名,MIG-2和D-因子為其別名。隨后,Donald Metcalf實驗室分別于1987年和1988年克隆出表達小鼠LIF和人LIF的基因[5,6]。
LIF的發現似乎給人們治療白血病帶來希望。然而深入的研究發現,LIF的作用非常廣泛,即使對于白血病細胞系,也是有些抑制,有些促進。因此,LIF與其它多功能的細胞因子,如TNF-等相似,很難應用于臨床。這些年來,LIF頗受關注。血液學家、神經生物學家、肌肉細胞生物學家、骨生物學家、內分泌生物學家和生殖生物學家都在研究LIF,可惜沒人能夠做深[7]。LIF目前最廣泛的應用還是在實驗室里用來培養小鼠胚胎干細胞,這在后面會詳述。
LIF因為可抑制小鼠M1白血病細胞的增殖而得名,那么科學家又是如何發現其在mES培養中的重要作用呢?科研充滿了巧合,但需要敏銳和發散性的思維去感觸這種巧合。
1981年劍橋大學的Martin Evans,Matthew Kaufman和美國加州大學舊金山分校(UCSF)的Gail Martin等首先從小鼠胚胎內細胞團(Inner Cell Mass, ICM)中獲得小鼠胚胎干細胞(mES)[8,9]的時候,必須在飼養層細胞(feeder cells)上進行培養,否則mES就會自發分化。
為分析飼養層細胞抑制mES分化的機制,人們從飼養層細胞的培養上清中分離出能夠抑制mES分化的成分[10,11]。但這些成分的抑制分化作用均弱于英國愛丁堡大學醫學院(University of Edinburgh Medical School)的Austin Smith于1986年從Buffalo大鼠肝臟細胞培養上清中分離出來的DIA(differentiation-inhibiting activity),即分化抑制活性蛋白[12]。后來,Austin Smith轉到英國牛津大學工作,并繼續研究DIA。1988年與美國Genetics Institute公司合作,Austin Smith在探討DIA是否可作用于ES細胞以外的細胞時,發現DIA能夠維持DA-1a (小鼠IL-3依賴的白血病細胞系)的持續生長[13]。湊巧的是,美國Genetics Institute公司新近剛克隆出一個能維持DA-1a細胞生長的造血生長因子基因,命名為HILDA(Human Interleukin for DA cells)。更重要的是,序列分析發現,HILDA基因與澳大利亞Donald Metcalf實驗室于同一年剛剛克隆出來的人LIF(hLIF)基因[6]序列一致,也就是說HILDA就是LIF[14]。美國Genetics Institute公司的這兩個工作連續發表在Nature雜志1988年的同一期中。
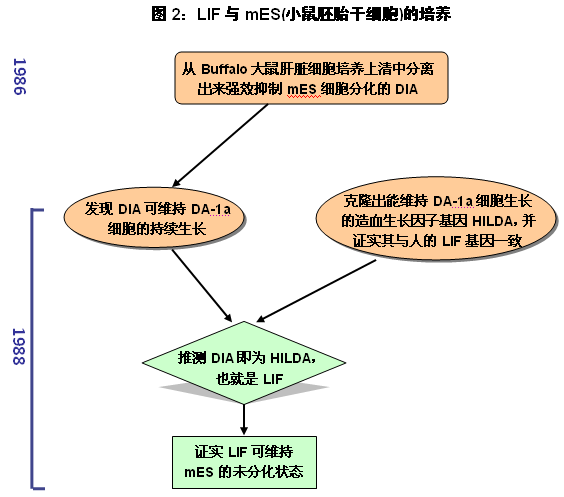
鑒于DIA和HILDA/LIF均能夠維持DA-1a的生長,Austin Smith就在想,HILDA/LIF是否也能和DIA一樣能夠抑制mES的分化。結果是令人振奮的!即將HILDA/LIF基因克隆進入非洲綠猴COS腎細胞中進行表達,COS細胞的培養上清可抑制mES細胞的分化。而且,考慮到DIA蛋白與HILDA/LIF蛋白的分子量也相近。因此推測,DIA應該就是LIF[13]。
上面的研究最重要的是發現了LIF可能就是能夠抑制mES分化的DIA,也揭示了LIF對不同細胞系具有不同的作用,甚至是截然相反的作用。對小鼠M1白血病細胞,LIF可促進其分化,而對于mES,LIF則抑制其分化。
估計國外科學家之間的溝通是非常多和及時的。同期,發現小鼠和人LIF的澳大利亞Donald Metcalf實驗室也敏銳地意識到DIA與LIF的相似性,并證實LIF(無論是人LIF,還是小鼠LIF)能維持mES的未分化狀態[15],該研究結果與美國Genetics Institute公司的兩個工作發表在1988年Nature雜志的同一期上。也就是說,Nature雜志1988年的同一期連續刊登了3篇關于LIF的文章,且都是講LIF與mES細胞培養的關系,可見LIF在mES細胞培養中的重要性。
因此在1988年底,也就是人的LIF剛剛被克隆出來的時候,人們就將目光轉向了LIF在mES培養中的作用。此后,沒人再去驗證DIA與LIF是否真為同一種物質,因只要得到了一種能夠強力抑制mES分化的因子(即LIF)就足夠了。
培養mES(小鼠胚胎干細胞)究竟是應該用mLIF(murine LIF, mLIF),還是hLIF(human LIF, hLIF),要從以下三個方面來考量:
第一,性能
hLIF和mLIF的發現者--澳大利亞Donald Metcalf實驗室研究證實,hLIF對小鼠M1髓系白血病細胞的誘導分化能力與mLIF相同或更好[6],也就是說hLIF完全可以替代mLIF來培養小鼠細胞。
更重要的是,1988年Donald Metcalf在Nature上饌文專門比較了hLIF和mLIF在維持mES細胞未分化狀態的能力,發現兩者完全一致,且最適用量均為1000 units/ml[15]。
有趣的是,hLIF可完全替代mLIF作用于小鼠細胞,但反過來,mLIF卻對人的細胞無效。這是什么原因呢?
研究表明,hLIF可與小鼠細胞上的mLIF受體(mLIF-R)結合,且親合力高于mLIF與mLIF受體的結合,這可能是hLIF對小鼠M1髓系白血病細胞的誘導分化能力比mLIF更好的原因。而mLIF不能與人細胞上的hLIF受體(hLIF-R)結合。 所以mLIF不能用于培養人的細胞[16]。
綜上所述,hLIF和mLIF在培養mES上的性能完全相同,可以相互替代,也就是說,完全可用hLIF來培養mES。
第二,價格
hLIF和mLIF的價格相差很大,主要原因是mLIF屬于專利產品,為一家公司獨有,其價格要高出hLIF 2-3倍之多。
Donald Metcalf等發現mLIF和hLIF,以及后期有關LIF的研究工作都是在澳大利亞AMRAD公司的資助下進行的,因此在后來申請專利時,發明者(Inventors)是Donald Metcalf實驗室的人員,但受讓人(Assignee,即專利的持有者)是澳大利亞AMRAD公司。后來,AMRAD公司自己在研制LIF藥物,而將mLIF的專利權授權給另外一家公司僅用于科學研究。
從表1中可以看出,hLIF比mLIF便宜很多,且有大包裝以及無動物成分(Animal Free)的hLIF可供選擇,因此從性價比考慮,培養mES最好用hLIF。
表1:人LIF和小鼠LIF的比較
| hLIF (人LIF) | mLIF (小鼠LIF) | |
| 氨基酸數目 | 180 | 180 |
| 氨基酸序列一致性 | 78% | |
| 分子量(非糖基化) | 19.6kD | 20kD |
| 糖基化程度 | 非常高 | |
| 糖基化與生物活性的關系 | 無 | |
| 生物學活性 | 對人和小鼠細胞的生物學活性完全相同 | 僅能作用于小鼠細胞 |
| 培養mES的工作濃度 | 1,000 units/ml 或10ng/ml | |
| 價格 | 以PeproTech公司的hLIF為例 (產品編號:300-05): | 專利擁有公司的產品編號分別為LIF2005和LIF2010: |
| 960元/5ug | 2071元/5ug | |
| 2340元/25ug 9,800元/100ug | 3077元/10ug 12,987元/ESG1107 | |
| 大包裝 | 有250ug,500ug和1mg等其它大包裝供選擇。包裝越大,相對單位成本越低。 | 無 |
| 無動物成分蛋白 | 有,產品編號為AF-300-05 | 無 |
第三,與其它動物的交叉反應
我們知道,目前商品化的LIF以人和小鼠為主,其它種屬的LIF很難買到。因此,如果您除了研究小鼠的ES(胚胎干細胞)或iPS(誘導多能干細胞),同時還研究其它動物,如牛、豬、犬、羊的ES或iPS,則不得不選用hLIF或者mLIF。
究竟是應該用hLIF,還是mLIF呢?國際上的標準是根據hLIF和mLIF與其它種屬動物LIF的同源性高低來確定。表2顯示,hLIF與牛、豬、犬、羊的LIF的氨基酸序列一致性均明顯高于mLIF,因此國際上通常用hLIF來培養這些動物的ES或iPS[17-20]。
表2:人LIF和小鼠與其它種屬LIF的氨基酸序列一致性
| hLIF (人LIF) | mLIF (小鼠LIF) | |
| 牛(Bovine) | 88% | 76% |
| 豬(Porcine) | 87% | 78% |
| 犬(Canine) | 91% | 80% |
| 羊(Sheep) | 89% | 77% |
總而言之,從性價比以及與其它種屬的交叉反應來考慮,用hLIF是明智的選擇。
hES(human ES,即人ES)細胞的獲得比mES晚了整整17年。 1998年,美國威斯康星大學麥迪遜分校的James Thomson和約翰·霍普金斯大學醫學院的Shamblott等首先分別從人ICM(Inner Cell Mass,內細胞團) 和PGCs (Primordial germ cells,原始生殖細胞)成功地建立了hES 細胞系[21, 22],從而開啟了對hES的科研和臨床研究。
依培養mES的經驗,在最初hES細胞的培養體系中也加入了hLIF以抑制hES的分化。但結果與預期的相悖,即hLIF無法維持hES細胞的未分化狀態。原因何在?
最初,人們推測hLIF不能抑制hES分化的原因是hES細胞表面缺乏hLIF的受體[23]。但美國加州大學圣地亞哥分校(UCSD)的Rohan Humphrey于2004年證實hES細胞上存在hLIF的受體,且hLIF與hES上的受體結合后可以激活JAK/STAT信號傳導途徑[24]。理論上如果JAK/STAT3信號傳導途徑被激活了,應該與hLIF或mLIF作用于mES相似,hES也應該保持未分化狀態。但結果確是,hES仍然會分化。所以該文作者認為,hES細胞的分化狀態與hLIF是否激活hES細胞的JAK/STAT3信號傳導途徑無關。
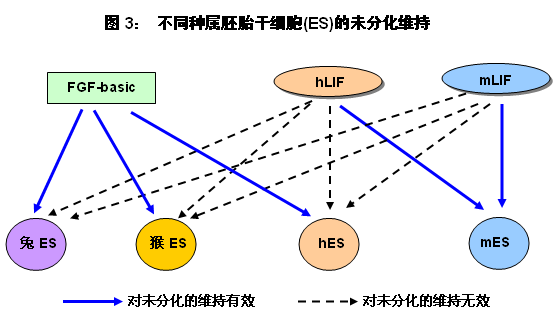
其實,不單是hES,LIF對猴(rhesus monkey)和兔(Rabbit)的ES也無效[25, 26]。 問題是,什么因子可抑制這些種屬ES(包括人、猴和兔的ES)的分化呢?答案是FGF-basic,即堿性成纖維細胞生長因子,又稱FGF-2。文獻[26-29]對FGF-basic在維持這些ES細胞未分化狀態中的作用進行了詳述。
1. mES(小鼠胚胎干細胞)的維持培養液 (有飼養層培養)
以配制500ml mES培養液為例。按下表配制,配制后,4oC可儲存2周。
| 組分 | 貯存液濃度 | 終濃度 | 終體積 |
| DMEM培養液(高糖) | 100% | 410ml | |
| FBS(胎牛血清) | 100% | 15% | 75ml |
| L-谷氨酰胺 | 200mM | 2mM | 5ml |
| 非必需氨基酸(NEAA) | 10mM | 0.1mM | 5ml |
| 丙酮酸鈉 | 100mM | 1mM | 5ml |
| b-巰基乙醇 | 14.3M | 0.1mM | 3.5ml |
| LIF | 50mg/ml | 10ng/ml | 0.1ml |
注:mES對FBS的質量非常敏感,請務必使用ES細胞驗證過的FBS。
2. hES(人胚胎干細胞)的維持培養液 (有飼養層培養)
以配制500ml hES培養液為例。按下表配制,配制后,4oC可儲存2周。
| 組分 | 貯存液濃度 | 終濃度 | 終體積 |
| DMEM-F12培養液 | 100% | 390ml | |
| KOSR(血清替代物) | 100% | 20% | 100ml |
| L-谷氨酰胺 | 200mM | 2mM | 5ml |
| 非必需氨基酸(NEAA) | 10mM | 0.1mM | 5ml |
| b-巰基乙醇 | 14.3M | 0.1mM | 3.5ml |
| FGF-basic | 20 mg/ml | 4ng/ml | 0.1ml |
3. hES(人胚胎干細胞)的維持培養液 (無飼養層培養)
為保證培養的最佳效果,最好使用商品化的hES無飼養層培養液,其優點為:
第一,含高品質的重組生長因子(FGF-basic和TGF-β1等)。
第二,極具競爭力的價格。
第三,細胞鋪板率高。
4. hLIF培養mES細胞的主要文獻
下面精選了一些用hLIF培養mES細胞的文獻,望對您有所幫助。
| 文章 | 期 刊 | 發表年份 | 2012年SCI影響因子 |
| Chung S, Moon JI, et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. 108(23):9703-8. | PNAS | 2011 | 9.737 |
| Stavridis MP, Lunn JS , et al. A discrete period of FGF-induced Erk1/2 signalling is required for vertebrate neural specification. 134(16):2889-94. | Development | 2007 | 6.208 |
| Billon N, Jolicoeur C, et al. Normal timing of oligodendrocyte development from genetically engineered, lineage-selectable mouse ES cells. 115(Pt 18):3657-65. | J. Cell Sci. | 2002 | 5.877 |
| Galvin KE, Travis ED, et al. Nodal Signaling Regulates the Bone Morphogenic Protein Pluripotency Pathway in Mouse Embryonic Stem Cells. 285(26):19747-56. | J. Biol. Chem. | 2010 | 4.651 |
| Saito K, Abe H, et al. Cloning of Complementary DNAs Encoding Structurally Related Homeoproteins from Preimplantation Mouse Embryos: Their Involvement in the Differentiation of Embryonic Stem Cells. 82(4):687-97. | Biol Reprod | 2010 | 4.027 |
| Tong M, Hernandez JL, et al. The intrinsic electrophysiological properties of neurons derived from mouse embryonic stem cells overexpressing neurogenin-1. 299(6):C1335-44. | Am J Physiol Cell Physiol | 2010 | 3.711 |
| Iha M, Watanabe M, et al. Effect of ectopic expression of homeoprotein EGAM1C on the cell morphology, growth, and differentiation in a mouse embryonic stem cell line, MG1.19 cells. 143(4):477-89. | Reproduction | 2012 | 3.555 |
| Wada H, Kojo S, et al. Successful differentiation to T cells, but unsuccessful B-cell generation, from B-cell-derived induced pluripotent stem cells. 23(1):65-74. | Int. Immunol | 2011 | 3.135 |
[1] Hozumi M. Fundamentals of chemotherapy of myeloid leukemia by induction of leukemia cell differentiation. Adv Cancer Res. 1983;38:121–169. PMID: 6192693
[2] Ichikawa Y. Differentiation of a cell line of myeloid leukemia. J Cell Physiol. 1969; 74(3):223-34. PMID: 4187945
[3] Lipton JH, Sachs L. Characterization of macrophage- and granulocyte-inducing proteins for normal and leukemic myeloid cells produced by the Krebs ascites tumor. Biochim Biophys Acta. 1981; 673(4):552-69. PMID: 7013820
[4] Tomida M, Yamamoto-Yamaguchi Y, Hozumi M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 1984; 259(17):10978-82. PMID: 6469994
[5] Gearing DP, Gough NM, King JA, Hilton DJ, Nicola NA, Simpson RJ, Nice EC, Kelso A, Metcalf D. Molecular cloning and expression of cDNA encoding a murine myeloid leukaemia inhibitory factor (LIF). EMBO J. 1987; 6(13):3995-4002. PMID: 3127201
[6] Gough NM, Gearing DP, King JA, Willson TA, Hilton DJ, Nicola NA, Metcalf D. Molecular cloning and expression of the human homologue of the murine gene encoding myeloid leukemia-inhibitory factor. Proc Natl Acad Sci U S A. 1988; 85(8):2623-7. PMID: 3128791
[7] Metcalf D. The unsolved enigmas of leukemia inhibitory factor. Stem Cells. 2003; 21(1):5-14. PMID: 12529546
[8] Evans MJ, Kaufman M. Establishment in culture of pluripotential cells from mouse embryos. Nature. 1981;292:154-6. PMID: 7242681
[9] Martin GR. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 1981; 78(12):7634-8. PMID: 6950406
[10] Smith TA, Hooper ML. Medium conditioned by feeder cells inhibits the differentiation of embryonal carcinoma cultures. Exp Cell Res. 1983; 145(2):458-62. PMID: 6861901
[11] Koopman P, Cotton RG.. A factor produced by feeder cells which inhibits embryonal carcinoma cell differentiation. Characterization and partial purification. Exp Cell Res. 1984; 154(1):233-42. PMID: 6468525
[12] Smith AG, Hooper ML. Buffalo rat liver cells produce a diffusible activity which inhibits the differentiation of murine embryonal carcinoma and embryonic stem cells. Dev Biol. 1987;121(1):1-9. PMID: 3569655
[13] Smith AG, Heath JK, Donaldson DD, Wong GG, Moreau J, Stahl M, Rogers D. Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides. Nature. 1988; 336(6200):688-90. PMID: 3143917
[14] Moreau JF, Donaldson DD, Bennett F, Witek-Giannotti J, Clark SC, Wong GG. Leukaemia inhibitory factor is identical to the myeloid growth factor human interleukin for DA cells. Nature. 1988; 336(6200):690-2. PMID: 3143918
[15] Williams RL, Hilton DJ, Pease S, Willson TA, Stewart CL, Gearing DP, Wagner EF, Metcalf D, Nicola NA, Gough NM. Myeloid leukaemia inhibitory factor maintains the developmental potential of embryonic stem cells. Nature. 1988; 336(6200):684-7. PMID: 3143916
[16] Owczarek CM, Layton MJ, Metcalf D, Lock P, Willson TA, Gough NM, Nicola NA. Inter-species chimeras of leukaemia inhibitory factor define a major human receptor-binding determinant. EMBO J. 1993;12(9):3487-95. PMID: 8253075
[17] Rodríguez A, De Frutos C, Díez C, Caama?o JN, Facal N, Duque P, García-Ochoa C, Gómez E. Effects of human versus mouse leukemia inhibitory factor on the in vitro development of bovine embryos. Theriogenology. 2007; 67(5):1092-5. PMID: 17210172
[18] Eckert J, Tao T, Niemann H. Ratio of inner cell mass and trophoblastic cells in blastocysts derived from porcine 4- and 8-cell embryos and isolated blastomeres cultured in vitro in the presence or absence of protein and human leukemia inhibitory factor. Biol Reprod. 1997; 57(3):552-60. PMID: 9282990
[19] Luo J, Suhr ST, Chang EA, Wang K, Ross PJ, Nelson LL, Venta PJ, Knott JG, Cibelli JB. Generation of leukemia inhibitory factor and basic fibroblast growth factor-dependent induced pluripotent stem cells from canine adult somatic cells. Stem Cells Dev. 2011; 20(10):1669-78. PMID: 21495906
[20] Fry RC, Batt PA, Fairclough RJ, Parr RA. Human leukemia inhibitory factor improves the viability of cultured ovine embryos. Biol Reprod. 1992; 46(3):470-4. PMID: 1617019
[21] Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, Jones JM. Embryonic stem cell lines derived from human blastocysts. Science. 1998; 282(5391):1145-7. PMID: 9804556
[22] Shamblott MJ, Axelman J, Wang S, Bugg EM, Littlefield JW, Donovan PJ, Blumenthal PD, Huggins GR, Gearhart JD. Derivation of pluripotent stem cells from cultured human primordial germ cells. Proc Natl Acad Sci U S A. 1998; 95(23):13726-31. PMID: 9811868
[23] Rose-John S. GP130 stimulation and the maintenance of stem cells. Trends Biotechnol. 2002; 20(10):417-9. PMID: 12220903
[24] Humphrey RK, Beattie GM, Lopez AD, Bucay N, King CC, Firpo MT, Rose-John S, Hayek A. Maintenance of pluripotency in human embryonic stem cells is STAT3 independent. Stem Cells. 2004; 22(4):522-30. PMID: 15277698
[25] Thomson JA, Kalishman J, Golos TG, Durning M, Harris CP, Becker RA, Hearn JP. Isolation of a primate embryonic stem cell line. Proc Natl Acad Sci U S A. 1995; 92(17):7844-8. PMID: 7544005
[26] Honda A, Hirose M, Ogura A. Basic FGF and Activin/Nodal but not LIF signaling sustain undifferentiated status of rabbit embryonic stem cells. Exp Cell Res. 2009; 315(12):2033-42. PMID: 19331817
[27] Xu, R.H., Peck, R.M., Li, D.S., Feng, X., Ludwig, T., and Thomson, J.A. Basic FGF and suppression of BMP signaling sustain undifferentiated proliferation of human ES cells. Nat. Methods. 2005; 2:185-190. PMID: 15782187
[28] Levenstein, M.E., Ludwig, T.E., Xu, R.H., Llanas, R.A., VanDenHeuvel-Kramer, K., Manning, D., and Thomson, J.A. Basic fibroblast growth factor support of human embryonic stem cell self-renewal. Stem Cells. 2006; 24:568-574. PMID: 16282444
[29] Byrne JA, Mitalipov SM, Clepper L, Wolf DP. Transcriptional Profiling of Rhesus Monkey Embryonic Stem Cells. Biol Reprod. 2006; 75(6):908-15. PMID: 16943365
[30] http://www.microscopyu.com/articles/livecellimaging/livecellmaintenance.html
[31] Welshons WV, Wolf MF, Murphy CS, Jordan VC. Estrogenic activity of phenol red. Mol Cell Endocrinol. 1988; 57(3):169-78. PMID:3402660
轉載自:生物探索
【上一篇】CST抗體選擇指南
【下一篇】BD PMG協助發現調控T細胞分化增殖的關鍵因素


